23 Nov 2021
Logran caracterizar una familia de proteínas que las bacterias patógenas usan para resistir antibióticos
El avance, realizado por científicos del Instituto Leloir y de Estados Unidos, sienta bases para desarrollar a futuro estrategias terapéuticas eficaces contra bacterias que causan neumonías, otitis agudas, infecciones en la piel y otras complicaciones.
 Daiana Capdevila, una de las directoras del estudio, jefa del Laboratorio de Fisicoquímica de Enfermedades Infecciosas de la FIL e investigadora del CONICET, y Mauro Bringas, becario postdoctoral del CONICET en el grupo de Capdevila y también autor del trabajo.
Daiana Capdevila, una de las directoras del estudio, jefa del Laboratorio de Fisicoquímica de Enfermedades Infecciosas de la FIL e investigadora del CONICET, y Mauro Bringas, becario postdoctoral del CONICET en el grupo de Capdevila y también autor del trabajo.
Las enfermedades infecciosas farmacorresistentes ya causan al menos 700 mil muertes al año en todo el mundo y el ritmo con el cual aparecen cepas resistentes a antibióticos predice que volverán a ser la principal causa de muerte a nivel mundial.
En este contexto, investigadores de la Fundación Instituto Leloir (FIL) y de Estados Unidos lograron describir la secuencia, la estructura y los movimientos que adopta una familia de proteínas que múltiples bacterias emplean para desarrollar resistencia al “ataque” del sistema inmune y de los antibióticos.
Las proteínas descritas en el estudio “podrían ser un blanco de terapias para afectar la virulencia de bacterias que causan altas tasas de morbilidad y mortalidad”, señaló la doctora en Química Daiana Capdevila, una de las directoras del estudio, jefa del Laboratorio de Fisicoquímica de Enfermedades Infecciosas de FIL.
Los mecanismos descritos en la investigación se estudiaron en Streptococcus pneumoniae (causante de neumonías y otitis agudas), Staphylococcus aureus (que causa infecciones en la piel y cuadros muy graves cuando es resistente a múltiples antibióticos), Enterococcus faecalis (comensal en intestino y causante de infecciones de tracto urinario frecuentemente resistentes a antibióticos) y Streptococcus mitis (que habita en la boca humana pero puede causar infecciones de tracto urinario).
El estudio también fue liderado por el bioquímico David Giedroc, de la Universidad de Indiana, Estados Unidos, y se publicó en la revista “Nucleic Acids Research”.
“Sensores de peligro”
Mediante herramientas bioinformáticas, estructurales y biofísicas, los investigadores describieron a nivel atómico las características principales de una familia de proteínas que usan las bacterias para defenderse de distintas fuentes de estrés en el hospedador humano y que se llaman CsoR.
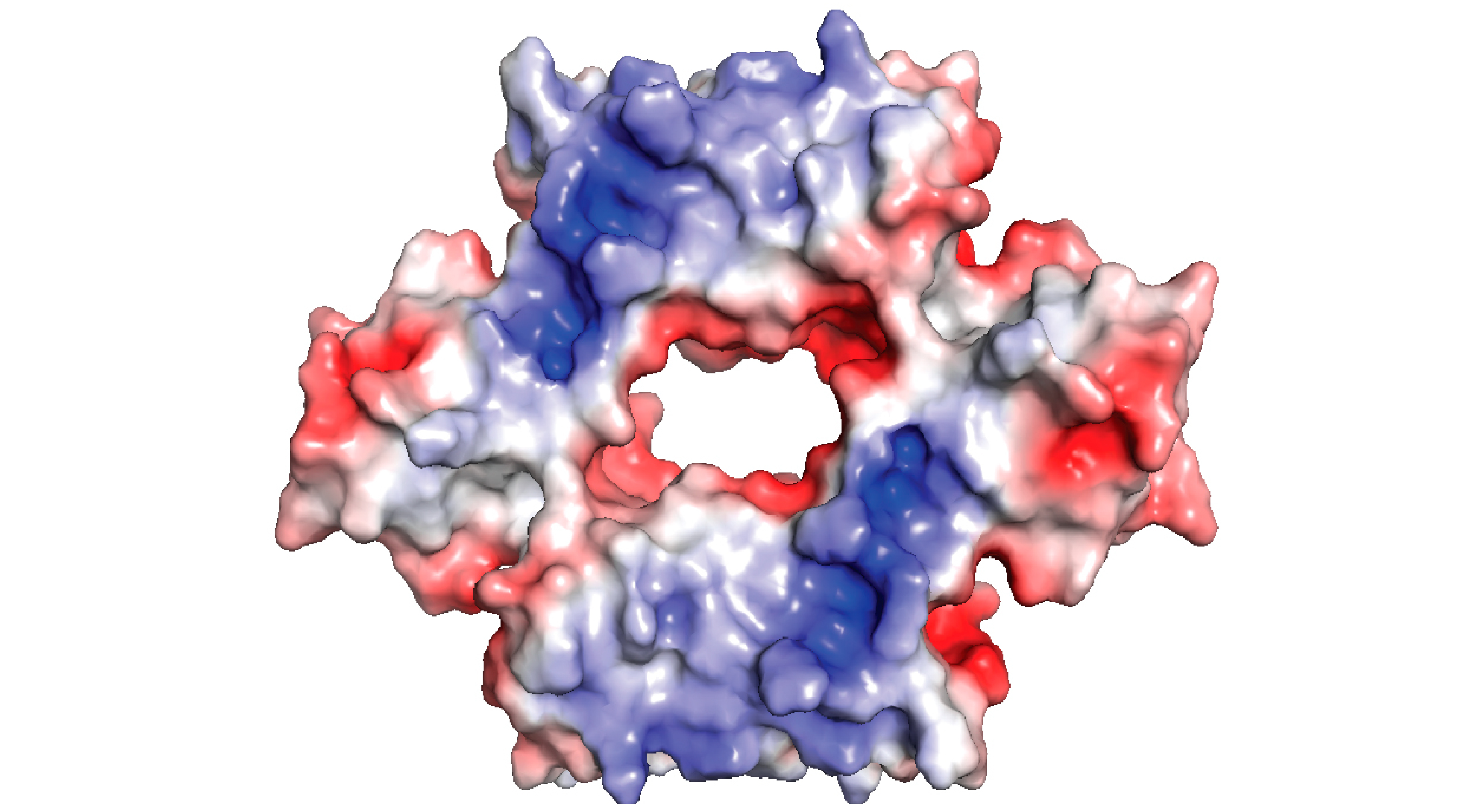 Imagen de una de las proteínas “CsoR” presentes en Streptococcus pneumoniae y otras bacterias patógenas, responsable de regular la resistencia al “ataque” del sistema inmune y de los antibióticos al unirse al ADN a través de las regiones en azul.
Imagen de una de las proteínas “CsoR” presentes en Streptococcus pneumoniae y otras bacterias patógenas, responsable de regular la resistencia al “ataque” del sistema inmune y de los antibióticos al unirse al ADN a través de las regiones en azul.
“Las proteínas CsoR se descubrieron en 2007 y desde entonces son objeto de estudio por diferentes grupos a nivel mundial”, explicó Capdevila, también investigadora del CONICET.
Por un lado, las bacterias emplean proteínas CsoR para detectar, con una especificidad extraordinaria, moléculas que si aumentan en el medio celular por efecto de los antibióticos y otras condiciones que enfrentan al infectar al humano, pueden sucumbir.
Algunas de esas moléculas “bactericidas” son iones o átomos metálicos, como el cobre, y especies reactivas de oxigeno formadas por oxígeno, radicales libres y otros elementos.
Una vez que las bacterias detectan esas moléculas “bactericidas”, despliegan estrategias de defensa para superar ese estrés y sobreponerse al afecto de los antibióticos, destacó Capdevila.
Además de detectar estas moléculas, las proteínas CsoR tienen la función de poner en marcha una estrategia de defensa para eliminarlas del medio celular.
Esos mecanismos de resistencia tienen que ver con la remediación o eliminación de las moléculas bactericidas, sobre todo especies reactivas de oxígeno, mediante el empleo de otras moléculas llamadas “especies reactivas de azufre” (RSS).
“Las bacterias patógenas usan las proteínas CsoR para detectar e inducir un nivel de concentración de RSS apropiado en el medio celular para reducir las especies reactivas de oxígeno y otros compuestos que ponen en riesgo su supervivencia. Al mismo tiempo controla que los niveles de RSS no sean excesivos porque de lo contrario pueden volverse tóxicos”, indicó Capdevila.
Los investigadores también pudieron postular, a partir de su análisis, que tanto los sensores o proteínas CsoR de cobre como los de RSS usaban dos átomos casi idénticos para unirse al compuesto toxico, pero con funciones distintas.
El trabajo argentino y estadounidense permitió tener una mirada general de toda la familia de proteínas CsoR. “Dado que las RSS son una pieza clave de las bacterias en su estrategia de defensa, la idea es usar esas proteínas como blanco terapéutico. Estudios posteriores tendrán que confirmar esa hipótesis y trazar un camino de estudios que contribuyan a mejorar en el futuro el abordaje médico de múltiples infecciones”, destacó Capdevila, ganadora del Premio Nacional L’Oréal-UNESCO “Por las Mujeres en la Ciencia” en la categoría Beca en 2020.
Del estudio también participaron Mauro Bringas, becario doctoral del CONICET en el grupo de Capdevila; y Joseph Fakhoury, Yifan Zhang, Katherine Edmonds, Justin Luebke y Giovanni Gonzalez-Gutierre, de la Universidad de Indiana.
 Daiana Capdevila, una de las directoras del estudio, jefa del Laboratorio de Fisicoquímica de Enfermedades Infecciosas de la FIL e investigadora del CONICET, y Mauro Bringas, becario postdoctoral del CONICET en el grupo de Capdevila y también autor del trabajo.
Daiana Capdevila, una de las directoras del estudio, jefa del Laboratorio de Fisicoquímica de Enfermedades Infecciosas de la FIL e investigadora del CONICET, y Mauro Bringas, becario postdoctoral del CONICET en el grupo de Capdevila y también autor del trabajo.Las enfermedades infecciosas farmacorresistentes ya causan al menos 700 mil muertes al año en todo el mundo y el ritmo con el cual aparecen cepas resistentes a antibióticos predice que volverán a ser la principal causa de muerte a nivel mundial.
En este contexto, investigadores de la Fundación Instituto Leloir (FIL) y de Estados Unidos lograron describir la secuencia, la estructura y los movimientos que adopta una familia de proteínas que múltiples bacterias emplean para desarrollar resistencia al “ataque” del sistema inmune y de los antibióticos.
Las proteínas descritas en el estudio “podrían ser un blanco de terapias para afectar la virulencia de bacterias que causan altas tasas de morbilidad y mortalidad”, señaló la doctora en Química Daiana Capdevila, una de las directoras del estudio, jefa del Laboratorio de Fisicoquímica de Enfermedades Infecciosas de FIL.
Los mecanismos descritos en la investigación se estudiaron en Streptococcus pneumoniae (causante de neumonías y otitis agudas), Staphylococcus aureus (que causa infecciones en la piel y cuadros muy graves cuando es resistente a múltiples antibióticos), Enterococcus faecalis (comensal en intestino y causante de infecciones de tracto urinario frecuentemente resistentes a antibióticos) y Streptococcus mitis (que habita en la boca humana pero puede causar infecciones de tracto urinario).
El estudio también fue liderado por el bioquímico David Giedroc, de la Universidad de Indiana, Estados Unidos, y se publicó en la revista “Nucleic Acids Research”.
“Sensores de peligro”
Mediante herramientas bioinformáticas, estructurales y biofísicas, los investigadores describieron a nivel atómico las características principales de una familia de proteínas que usan las bacterias para defenderse de distintas fuentes de estrés en el hospedador humano y que se llaman CsoR.
 Imagen de una de las proteínas “CsoR” presentes en Streptococcus pneumoniae y otras bacterias patógenas, responsable de regular la resistencia al “ataque” del sistema inmune y de los antibióticos al unirse al ADN a través de las regiones en azul.
Imagen de una de las proteínas “CsoR” presentes en Streptococcus pneumoniae y otras bacterias patógenas, responsable de regular la resistencia al “ataque” del sistema inmune y de los antibióticos al unirse al ADN a través de las regiones en azul.“Las proteínas CsoR se descubrieron en 2007 y desde entonces son objeto de estudio por diferentes grupos a nivel mundial”, explicó Capdevila, también investigadora del CONICET.
Por un lado, las bacterias emplean proteínas CsoR para detectar, con una especificidad extraordinaria, moléculas que si aumentan en el medio celular por efecto de los antibióticos y otras condiciones que enfrentan al infectar al humano, pueden sucumbir.
Algunas de esas moléculas “bactericidas” son iones o átomos metálicos, como el cobre, y especies reactivas de oxigeno formadas por oxígeno, radicales libres y otros elementos.
Una vez que las bacterias detectan esas moléculas “bactericidas”, despliegan estrategias de defensa para superar ese estrés y sobreponerse al afecto de los antibióticos, destacó Capdevila.
Además de detectar estas moléculas, las proteínas CsoR tienen la función de poner en marcha una estrategia de defensa para eliminarlas del medio celular.
Esos mecanismos de resistencia tienen que ver con la remediación o eliminación de las moléculas bactericidas, sobre todo especies reactivas de oxígeno, mediante el empleo de otras moléculas llamadas “especies reactivas de azufre” (RSS).
“Las bacterias patógenas usan las proteínas CsoR para detectar e inducir un nivel de concentración de RSS apropiado en el medio celular para reducir las especies reactivas de oxígeno y otros compuestos que ponen en riesgo su supervivencia. Al mismo tiempo controla que los niveles de RSS no sean excesivos porque de lo contrario pueden volverse tóxicos”, indicó Capdevila.
Los investigadores también pudieron postular, a partir de su análisis, que tanto los sensores o proteínas CsoR de cobre como los de RSS usaban dos átomos casi idénticos para unirse al compuesto toxico, pero con funciones distintas.
El trabajo argentino y estadounidense permitió tener una mirada general de toda la familia de proteínas CsoR. “Dado que las RSS son una pieza clave de las bacterias en su estrategia de defensa, la idea es usar esas proteínas como blanco terapéutico. Estudios posteriores tendrán que confirmar esa hipótesis y trazar un camino de estudios que contribuyan a mejorar en el futuro el abordaje médico de múltiples infecciones”, destacó Capdevila, ganadora del Premio Nacional L’Oréal-UNESCO “Por las Mujeres en la Ciencia” en la categoría Beca en 2020.
Del estudio también participaron Mauro Bringas, becario doctoral del CONICET en el grupo de Capdevila; y Joseph Fakhoury, Yifan Zhang, Katherine Edmonds, Justin Luebke y Giovanni Gonzalez-Gutierre, de la Universidad de Indiana.
