26 Ago 2022
Determinan cómo se originan ciertas células del sistema nervioso central, claves para el funcionamiento de los circuitos neuronales
Guillermo Lanuza y su equipo del Laboratorio de Genética del Desarrollo Neural, descifraron aspectos fundamentales de la creación y diferenciación de los astrocitos durante el desarrollo embrionario. Como estas células están involucradas en distintas enfermedades neurodegenerativas, el hallazgo puede ser la base para el diseño de futuras terapias. El estudio fue tapa de la revista Development.


Por su función fundamental en la transmisión de información, las neuronas son las grandes estrellas del sistema nervioso. Sin embargo, cada vez se le da más importancia al estudio de otras células que lo componen y que con un perfil más bajo cumplen un rol esencial en la organización cerebral: se trata de los astrocitos, a los que históricamente se consideró como meros componentes de soporte estructural, y que ahora se sabe que tienen un papel importante en la organización de las conexiones entre las neuronas y el funcionamiento de los circuitos neuronales.
Para comprender más sobre cómo se originan los astrocitos, por qué a veces se altera su funcionamiento y, eventualmente, abordar mejor ciertos desórdenes neurológicos, un estudio liderado por Guillermo Lanuza, jefe del Laboratorio de Genética del Desarrollo Neural de la Fundación Instituto Leloir (FIL), determinó el mecanismo por el cual se crean y se regula su diversidad durante el desarrollo embrionario. Publicado en la revista Development, el trabajo no sólo fue la tapa del número de agosto, sino que además fue resaltado con un “highlight” (destacado o sobresaliente) por parte de los editores.
“A pesar de que los astrocitos son el tipo celular más abundante del sistema nervioso central, que cumplen roles fundamentales para su funcionamiento y que están involucrados en diversas patologías neurodegenerativas, no se conocen con certeza los mecanismos que guían su producción, ni cuáles son los orígenes de su diversidad”, señala Lanuza. Y agrega: “En este trabajo nos concentramos en la médula espinal, que alberga los circuitos responsables del movimiento corporal y del procesamiento de la información sensorial”.
Las neuronas y las células de la glía como los astrocitos se producen a partir de células progenitoras neurales multipotentes. Para definir si los astrocitos que cumplen diferentes roles y se ubican en distintas zonas de la médula tienen diferente origen embrionario, Lanuza y su equipo se concentraron en un grupo restringido de células progenitoras en el tubo neural (precursor del sistema nervioso central en el embrión) identificado por la expresión de la proteína Dbx1.
Para eso, a través del uso de genética molecular en el ratón, “etiquetaron” todas las células producidas por esas células progenitoras Dbx1 y encontraron que además de neuronas, generaban astrocitos en fases más avanzadas del desarrollo. “Determinamos que la población de astrocitos derivada de progenitores Dbx1 se ubica con asombrosa precisión en un lugar definido de la médula espinal, sin entremezclarse con células gliales que se producen a partir de otros progenitores. Además, estos astrocitos expresan genes específicos que los diferencian de los presentes en otras regiones de la médula”, asegura Lanuza.
Según el científico, la cartografía de astrocitos que hallaron en la médula espinal postnatal indica que distintos grupos de células embrionarias están encargadas de poblar determinadas regiones del sistema nervioso y no otras. “Pensamos que este mecanismo está moldeado para proveer un número óptimo de subtipos de astrocitos para sostener el correcto funcionamiento de las neuronas de cada región de la médula y el ensamblado de las conexiones sinápticas entre ellas”, explica.
Para comprender más sobre cómo se originan los astrocitos, por qué a veces se altera su funcionamiento y, eventualmente, abordar mejor ciertos desórdenes neurológicos, un estudio liderado por Guillermo Lanuza, jefe del Laboratorio de Genética del Desarrollo Neural de la Fundación Instituto Leloir (FIL), determinó el mecanismo por el cual se crean y se regula su diversidad durante el desarrollo embrionario. Publicado en la revista Development, el trabajo no sólo fue la tapa del número de agosto, sino que además fue resaltado con un “highlight” (destacado o sobresaliente) por parte de los editores.
“A pesar de que los astrocitos son el tipo celular más abundante del sistema nervioso central, que cumplen roles fundamentales para su funcionamiento y que están involucrados en diversas patologías neurodegenerativas, no se conocen con certeza los mecanismos que guían su producción, ni cuáles son los orígenes de su diversidad”, señala Lanuza. Y agrega: “En este trabajo nos concentramos en la médula espinal, que alberga los circuitos responsables del movimiento corporal y del procesamiento de la información sensorial”.
Las neuronas y las células de la glía como los astrocitos se producen a partir de células progenitoras neurales multipotentes. Para definir si los astrocitos que cumplen diferentes roles y se ubican en distintas zonas de la médula tienen diferente origen embrionario, Lanuza y su equipo se concentraron en un grupo restringido de células progenitoras en el tubo neural (precursor del sistema nervioso central en el embrión) identificado por la expresión de la proteína Dbx1.
Para eso, a través del uso de genética molecular en el ratón, “etiquetaron” todas las células producidas por esas células progenitoras Dbx1 y encontraron que además de neuronas, generaban astrocitos en fases más avanzadas del desarrollo. “Determinamos que la población de astrocitos derivada de progenitores Dbx1 se ubica con asombrosa precisión en un lugar definido de la médula espinal, sin entremezclarse con células gliales que se producen a partir de otros progenitores. Además, estos astrocitos expresan genes específicos que los diferencian de los presentes en otras regiones de la médula”, asegura Lanuza.
Según el científico, la cartografía de astrocitos que hallaron en la médula espinal postnatal indica que distintos grupos de células embrionarias están encargadas de poblar determinadas regiones del sistema nervioso y no otras. “Pensamos que este mecanismo está moldeado para proveer un número óptimo de subtipos de astrocitos para sostener el correcto funcionamiento de las neuronas de cada región de la médula y el ensamblado de las conexiones sinápticas entre ellas”, explica.
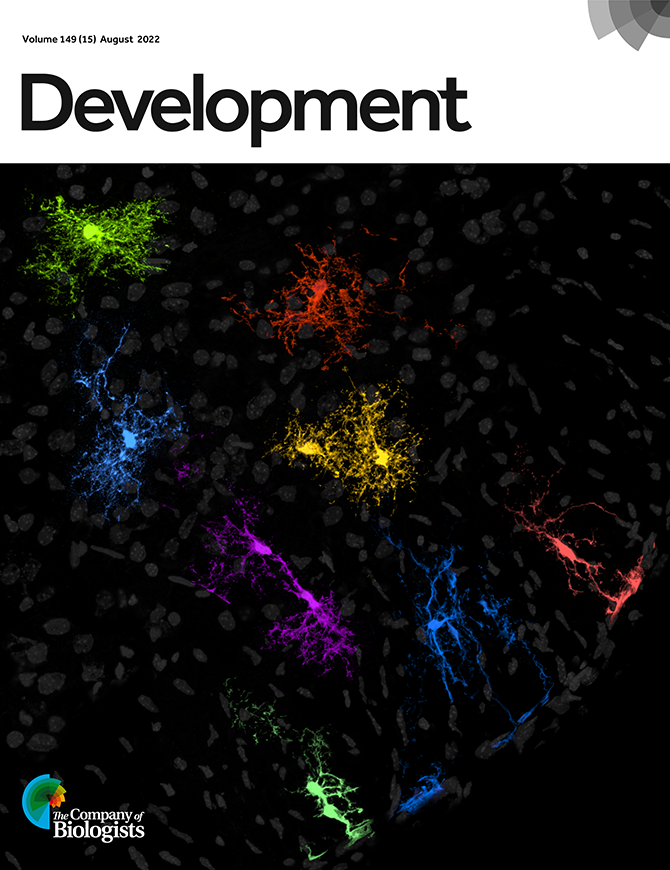
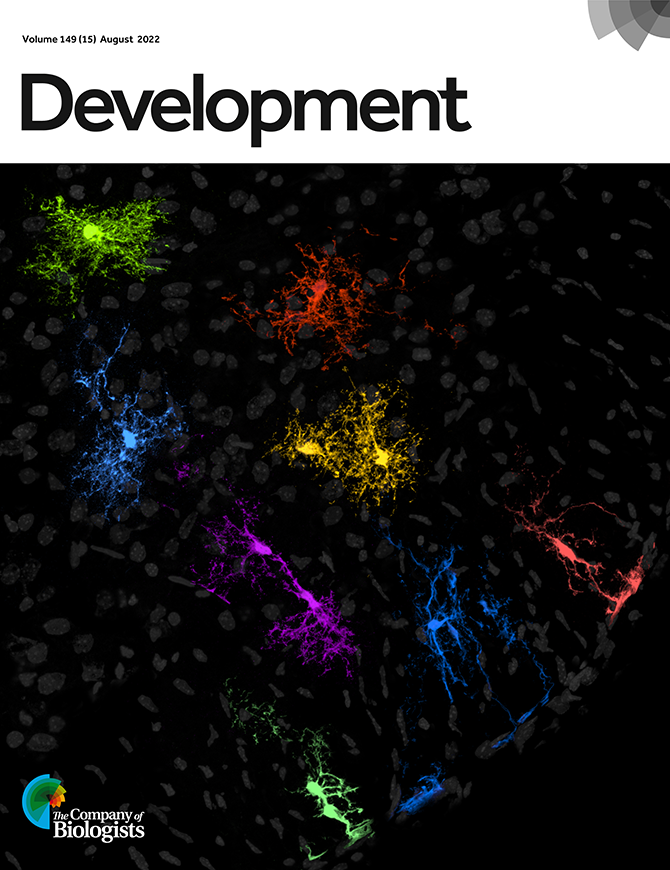
Pero eso no es todo. Los investigadores también analizaron la participación del factor de transcripción Dbx1 (proteína que enciende o apaga ciertos genes) en la generación de astrocitos. Para esto, obtuvieron embriones de ratones a los que le eliminaron el gen Dbx1 y encontraron que su médula espinal contenía un número mayor de astrocitos, y que éstos se generaban a expensas de neuronas.
“Estos resultados indican que Dbx1 es parte del programa genético que controla la ‘decisión’ de las células progenitoras neurales para producir neuronas o células de la glía. Encontramos además que la influencia de Dbx1 en las identidades celulares se debe a cambios en la vía de comunicación intercelular de Notch, usualmente partícipe en la determinación de destinos celulares durante el desarrollo”, describe Lanuza. Y concluye: “Este estudio demuestra que aspectos importantes de la distribución y heterogeneidad astrocítica se determinan en el desarrollo embrionario. La comprensión de los principios básicos del origen de la diversidad de la glía contribuirá a identificar subclases de astrocitos cuyo funcionamiento se encuentra alterado en diversos desórdenes neurológicos y frente a daños del sistema nervioso”.
Micaela Sartoretti y Carla Campetella, del grupo de Lanuza, también son autoras del trabajo publicado en la revista Development.
“Estos resultados indican que Dbx1 es parte del programa genético que controla la ‘decisión’ de las células progenitoras neurales para producir neuronas o células de la glía. Encontramos además que la influencia de Dbx1 en las identidades celulares se debe a cambios en la vía de comunicación intercelular de Notch, usualmente partícipe en la determinación de destinos celulares durante el desarrollo”, describe Lanuza. Y concluye: “Este estudio demuestra que aspectos importantes de la distribución y heterogeneidad astrocítica se determinan en el desarrollo embrionario. La comprensión de los principios básicos del origen de la diversidad de la glía contribuirá a identificar subclases de astrocitos cuyo funcionamiento se encuentra alterado en diversos desórdenes neurológicos y frente a daños del sistema nervioso”.
Micaela Sartoretti y Carla Campetella, del grupo de Lanuza, también son autoras del trabajo publicado en la revista Development.
