04 Jun 2018
Dr. Armando Parodi, el discípulo del Dr. Leloir que abrió nuevos campos de investigación
En muchas patologías de origen genético, como la fibrosis quística, las mutaciones impiden que las proteínas se plieguen bien y puedan cumplir su función biológica de manera adecuada.
 El Dr. Armando Parodi, uno de los investigadores más importantes del país, fue incorporado en el año 2000 a la prestigiosa Academia Nacional de Ciencias de Estados Unidos.
El Dr. Armando Parodi, uno de los investigadores más importantes del país, fue incorporado en el año 2000 a la prestigiosa Academia Nacional de Ciencias de Estados Unidos.
Para entender mejor este proceso, el doctor Armando Parodi, quien lideró el Laboratorio de Glicobiología de la Fundación Instituto Leloir, explica que hay que visualizar a las proteínas como una estructura lineal, como un piolín, y que luego de ser formadas en el organismo deben adoptar una estructura espacial, tridimensional, propia de cada proteína. “Siguiendo con el símil anterior, el piolín pasa a ser un ovillo con una forma exclusiva para cada polín. Y esa forma es la que le confiere a las proteínas sus propiedades biológicas características. En el caso de la enfermedad de Alzheimer y el Parkinson, la acumulación de proteínas que adoptan una forma tridimensional incorrecta constituye una de sus causas subyacentes”, indica Parodi quien realizó su Tesis Doctoral bajo la dirección del Premio Nobel de Química, el doctor Luis Federico Leloir.
Este proceso de plegamiento es muy azaroso y en muchas ocasiones la estructura tridimensional que adopta una determinada proteína es incorrecta. Al no tener las propiedades biológicas necesarias, dicha proteína es inservible y debe ser destruida. ¿Cómo hace la célula para ayudar a las proteínas a lograr las estructuras tridimensionales correctas? ¿Cómo hace la célula para saber si una proteína está correctamente plegada y debe continuar su vida útil, pero si no lo está, destruirla? Las respuestas a estas preguntas es lo que se denomina “control de calidad del plegamiento de proteínas”. Por hacer aportes fundamentales en el estudio de este control en el caso de proteínas unidas a azúcares (las llamadas glicoproteínas que constituyen aproximadamente un 35% de las proteínas totales de una célula de mamífero) el doctor Parodi fue incorporado en el año 2000 a la prestigiosa Academia Nacional de Ciencias de Estados Unidos.
Luego de terminada su Tesis Doctoral bajo la dirección del doctor Leloir, Parodi abrió nuevos campos de investigación relevantes para la ciencia tras publicar sus primeros hallazgos sobre el control de calidad de plegamiento de glicoproteínas en tres trabajos pioneros publicados en 1983 y 1984 en la prestigiosa revista “The Journal of Biological Chemistry”, publicación de la Asociación Americana de Bioquímica y Biología Molecular. Desde entonces, fueron muchos los estudios del grupo del doctor Parodi, publicados en revistas prestigiosas, que contribuyeron a comprender las diferentes etapas del mecanismo de control de calidad del plegamiento de glicoproteínas.
Ciertas enfermedades congénitas debidas a mutaciones en diversas glicoproteínas claves para la vida del ser humano “pueden ser explicadas porque la maquinaria celular estudiada en mi laboratorio no es capaz de llevar a dichas glicoproteínas a adoptar una estructura tridimensional correcta y/o no puede la célula detectar una glicoproteína mal plegada que debe ser destruida. Es muy temprano aún para decir si mis estudios han llevado ya al desarrollo de nuevos tratamientos, pero constituyen un aporte en esa dirección”, indica Parodi quien llegó a ser Investigador Superior del CONICET.
Por su trayectoria y trabajos, Parodi también es Miembro Titular de la Academia Nacional de Ciencias Exactas, Físicas y Naturales, de la American Academy of Microbiology y de otras sociedades científicas. Ha recibido becas de la American Cancer Society y de la John S. Guggenheim Memorial Foundation, ha sido asesor de la Organización Mundial de la Salud e investigador internacional del prestigioso Instituto Médico Howard Hughes (HHMI, por sus siglas en inglés). La American Society for Glycobiology lo describió como uno de los científicos más destacados de su campo de los últimos 50 años cuando en 2011 lo distinguió con el premio “Karl Meyer”.
Parodi: Demostré que si una glicoproteína no está bien plegada, una enzima (proteína con propiedades catalíticas) detecta esta anomalía y le agrega una glucosa. Este azúcar funciona como si fuera un ‘código de barras’, es decir, una señal que le indica a la célula que debe ayudar a esa glicoproteína a adoptar la estructura tridimensional correcta, y que, si finalmente no lo logra, debe destruirla. Si la glicoproteína con la glucosa termina adoptando una forma adecuada, la glucosa que la ha “marcado” es liberada y entonces la célula permite que pueda cumplir su función específica, pero si no logra llegar a la estructura tridimensional correcta, la célula destruye a dicha glicoproteína.
 El Dr. Armando Parodi (der.) realizó su tesis de doctorado bajo la dirección del doctor Luis Federico Leloir (izq.), premio Nobel de Química de 1970. En la foto también figura el doctor José Mordoh, actual jefe del Laboratorio de Cancerología del Instituto Leloir.
El Dr. Armando Parodi (der.) realizó su tesis de doctorado bajo la dirección del doctor Luis Federico Leloir (izq.), premio Nobel de Química de 1970. En la foto también figura el doctor José Mordoh, actual jefe del Laboratorio de Cancerología del Instituto Leloir.
En el primer trabajo, publicado en 1983, lo hallamos estudiando la síntesis de glicoproteínas en Trypanosoma cruzi, el parásito que causa la enfermedad de Chagas. En estudios posteriores comprobamos que ese sistema de control de calidad de plegamiento de glicoproteínas también ocurría en otros sistemas como en células de mamíferos, de plantas y en hongos. Más adelante identificamos a la enzima (una glucosiltransferasa) que es la encargada de agregar la glucosa a las glicoproteínas para ‘avisar’ a las células que dichas glicoproteínas tienen problemas en su plegamiento.
Sí, mi padre, un prestigioso médico e investigador del CONICET despertó mi interés por la ciencia. Cuando me recibí de Licenciado en Química en la década de 1960, mi padre decía que el mejor lugar para hacer una tesis doctoral era la Fundación Campomar (hoy Fundación Instituto Leloir). Había tres vacantes a las que se accedía tras aprobar un exigente curso de un semestre de duración. Di el examen y me fui de vacaciones. Luego supe que fui uno de los tres seleccionados. Los otros dos ya habían elegido a su director de tesis. El único jefe de laboratorio que quedaba libre era el doctor Leloir. Colaboré en sus líneas de investigación y terminé mi tesis de doctorado en 1970, el mismo año en que Leloir ganó el premio Nobel de Química.
Fue una experiencia decisiva. Tuve la suerte de trabajar bajo su dirección durante 7 años, en un momento que abrió todo un campo de la bioquímica que es la síntesis de glicoproteínas, un área de la investigación en la que continué trabajando, no solo yo sino varios grupos de investigación de todo el mundo. Esta línea de investigación es muy importante. Los anticuerpos, muchas hormonas y muchas enzimas son glicoproteínas que cumplen un rol clave en procesos vitales.
Así es. Él obtuvo el máximo galardón de la ciencia por describir los mecanismos de síntesis de compuestos que tienen azúcares, un proceso clave de la vida. Describió cómo se almacenan los azúcares en animales bajo la forma de glucógeno y de almidón en plantas y el modo en que se utilizan como fuente de energía. Estos trabajos permitieron explicar muchas enfermedades hereditarias como la galactosemia. Pero sus trabajos pioneros en la formación de glicoproteínas son de igual relevancia.
De Leloir aprendí modos eficientes de trabajar en equipo, encarar preguntas, diseñar experimentos y analizar los resultados. Estimulaba la autonomía. Ni bien comencé a trabajar con él, fabricábamos algunos de nuestros equipos de laboratorio para realizar experimentos. En 1965 construimos el primer “vortex” utilizado en el instituto. Este aparatito sirve para mezclar y homogeneizar las sustancias contenidas en tubos de ensayo. Lo construimos con el motor de un secador de cabello en desuso de mi hermana y funcionaba muy bien. Por otra parte, al igual que Leloir, siempre me gustó realizar experimentos con mis propias manos, en tareas compartidas con mis becarios.
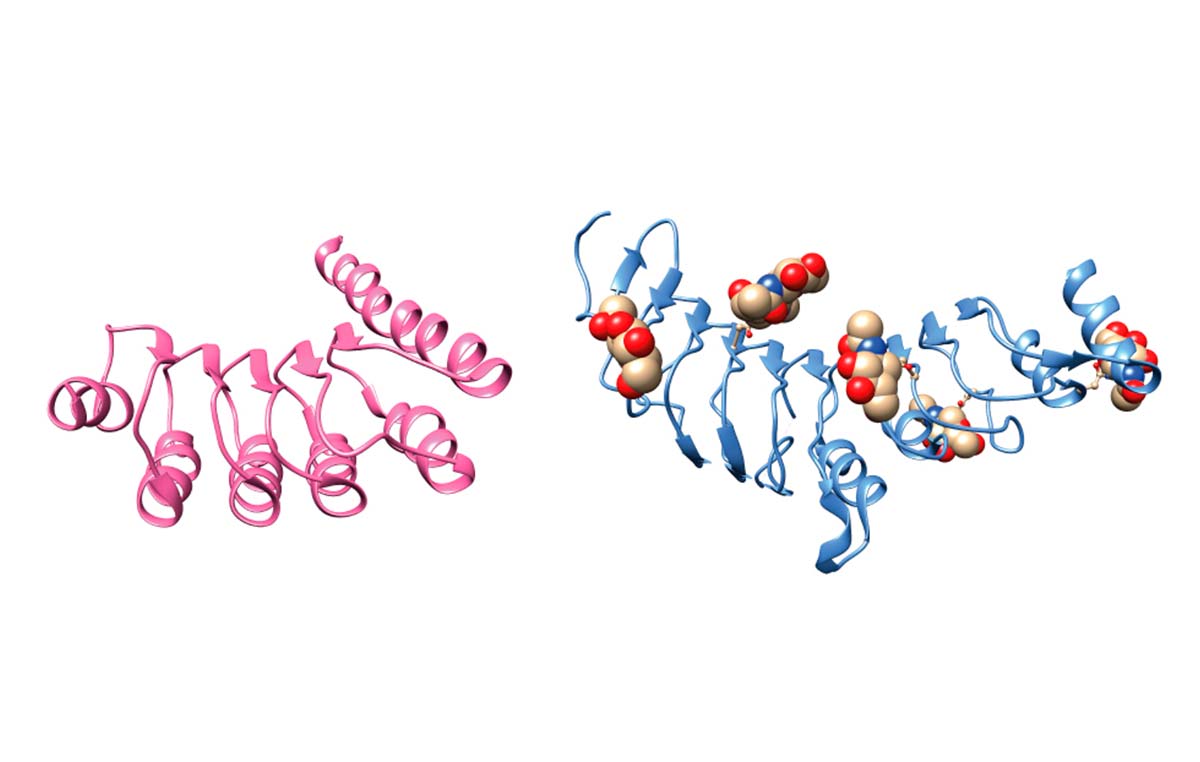 Proteína sin azúcar (izq.) y con azúcar (glicoproteínas). Ciertas enfermedades congénitas se producen a causa de mutaciones en diversas glicoproteínas claves para la vida del ser humano. Parodi logró explicar por qué la maquinaria celular no es capaz de llevar a dichas moléculas a adoptar una estructura tridimensional correcta y/o no puede la célula detectar que está mal plegada y así destruirla.
Proteína sin azúcar (izq.) y con azúcar (glicoproteínas). Ciertas enfermedades congénitas se producen a causa de mutaciones en diversas glicoproteínas claves para la vida del ser humano. Parodi logró explicar por qué la maquinaria celular no es capaz de llevar a dichas moléculas a adoptar una estructura tridimensional correcta y/o no puede la célula detectar que está mal plegada y así destruirla.
Esta distinción es falaz. Lo que existe es ciencia y aplicación de la ciencia. Prácticamente todos los grandes avances en biotecnología y en tecnología propiamente dicha derivan de estudios básicos seguidos no con un fin práctico determinado sino simplemente con la finalidad de aumentar el conocimiento que posee la humanidad sobre la naturaleza. Este aumento es la estrategia que, a la larga, ha brindado los mayores avances en el diagnóstico y tratamiento de enfermedades humanas. Hay una infinidad de investigaciones brillantes que buscando, no explicar enfermedades, sino el funcionamiento de las células, llevaron inesperadamente al desarrollo de diagnósticos y tratamientos eficaces para muchas patologías. En mi caso personal, el estudio de cómo se forman las glicoproteínas en un microrganismo (Trypanosoma cruzi) llevó a explicar un sinnúmero de patologías humanas. Algo realmente inesperado y que muestra tanto la utilidad como la belleza de la investigación básica.
 El Dr. Armando Parodi, uno de los investigadores más importantes del país, fue incorporado en el año 2000 a la prestigiosa Academia Nacional de Ciencias de Estados Unidos.
El Dr. Armando Parodi, uno de los investigadores más importantes del país, fue incorporado en el año 2000 a la prestigiosa Academia Nacional de Ciencias de Estados Unidos.Para entender mejor este proceso, el doctor Armando Parodi, quien lideró el Laboratorio de Glicobiología de la Fundación Instituto Leloir, explica que hay que visualizar a las proteínas como una estructura lineal, como un piolín, y que luego de ser formadas en el organismo deben adoptar una estructura espacial, tridimensional, propia de cada proteína. “Siguiendo con el símil anterior, el piolín pasa a ser un ovillo con una forma exclusiva para cada polín. Y esa forma es la que le confiere a las proteínas sus propiedades biológicas características. En el caso de la enfermedad de Alzheimer y el Parkinson, la acumulación de proteínas que adoptan una forma tridimensional incorrecta constituye una de sus causas subyacentes”, indica Parodi quien realizó su Tesis Doctoral bajo la dirección del Premio Nobel de Química, el doctor Luis Federico Leloir.
Este proceso de plegamiento es muy azaroso y en muchas ocasiones la estructura tridimensional que adopta una determinada proteína es incorrecta. Al no tener las propiedades biológicas necesarias, dicha proteína es inservible y debe ser destruida. ¿Cómo hace la célula para ayudar a las proteínas a lograr las estructuras tridimensionales correctas? ¿Cómo hace la célula para saber si una proteína está correctamente plegada y debe continuar su vida útil, pero si no lo está, destruirla? Las respuestas a estas preguntas es lo que se denomina “control de calidad del plegamiento de proteínas”. Por hacer aportes fundamentales en el estudio de este control en el caso de proteínas unidas a azúcares (las llamadas glicoproteínas que constituyen aproximadamente un 35% de las proteínas totales de una célula de mamífero) el doctor Parodi fue incorporado en el año 2000 a la prestigiosa Academia Nacional de Ciencias de Estados Unidos.
Luego de terminada su Tesis Doctoral bajo la dirección del doctor Leloir, Parodi abrió nuevos campos de investigación relevantes para la ciencia tras publicar sus primeros hallazgos sobre el control de calidad de plegamiento de glicoproteínas en tres trabajos pioneros publicados en 1983 y 1984 en la prestigiosa revista “The Journal of Biological Chemistry”, publicación de la Asociación Americana de Bioquímica y Biología Molecular. Desde entonces, fueron muchos los estudios del grupo del doctor Parodi, publicados en revistas prestigiosas, que contribuyeron a comprender las diferentes etapas del mecanismo de control de calidad del plegamiento de glicoproteínas.
Ciertas enfermedades congénitas debidas a mutaciones en diversas glicoproteínas claves para la vida del ser humano “pueden ser explicadas porque la maquinaria celular estudiada en mi laboratorio no es capaz de llevar a dichas glicoproteínas a adoptar una estructura tridimensional correcta y/o no puede la célula detectar una glicoproteína mal plegada que debe ser destruida. Es muy temprano aún para decir si mis estudios han llevado ya al desarrollo de nuevos tratamientos, pero constituyen un aporte en esa dirección”, indica Parodi quien llegó a ser Investigador Superior del CONICET.
Por su trayectoria y trabajos, Parodi también es Miembro Titular de la Academia Nacional de Ciencias Exactas, Físicas y Naturales, de la American Academy of Microbiology y de otras sociedades científicas. Ha recibido becas de la American Cancer Society y de la John S. Guggenheim Memorial Foundation, ha sido asesor de la Organización Mundial de la Salud e investigador internacional del prestigioso Instituto Médico Howard Hughes (HHMI, por sus siglas en inglés). La American Society for Glycobiology lo describió como uno de los científicos más destacados de su campo de los últimos 50 años cuando en 2011 lo distinguió con el premio “Karl Meyer”.
-¿Cómo funciona exactamente el sistema de control de calidad de proteínas que descubrió?
Parodi: Demostré que si una glicoproteína no está bien plegada, una enzima (proteína con propiedades catalíticas) detecta esta anomalía y le agrega una glucosa. Este azúcar funciona como si fuera un ‘código de barras’, es decir, una señal que le indica a la célula que debe ayudar a esa glicoproteína a adoptar la estructura tridimensional correcta, y que, si finalmente no lo logra, debe destruirla. Si la glicoproteína con la glucosa termina adoptando una forma adecuada, la glucosa que la ha “marcado” es liberada y entonces la célula permite que pueda cumplir su función específica, pero si no logra llegar a la estructura tridimensional correcta, la célula destruye a dicha glicoproteína.
 El Dr. Armando Parodi (der.) realizó su tesis de doctorado bajo la dirección del doctor Luis Federico Leloir (izq.), premio Nobel de Química de 1970. En la foto también figura el doctor José Mordoh, actual jefe del Laboratorio de Cancerología del Instituto Leloir.
El Dr. Armando Parodi (der.) realizó su tesis de doctorado bajo la dirección del doctor Luis Federico Leloir (izq.), premio Nobel de Química de 1970. En la foto también figura el doctor José Mordoh, actual jefe del Laboratorio de Cancerología del Instituto Leloir.-¿En qué modelos descubrió este mecanismo?
En el primer trabajo, publicado en 1983, lo hallamos estudiando la síntesis de glicoproteínas en Trypanosoma cruzi, el parásito que causa la enfermedad de Chagas. En estudios posteriores comprobamos que ese sistema de control de calidad de plegamiento de glicoproteínas también ocurría en otros sistemas como en células de mamíferos, de plantas y en hongos. Más adelante identificamos a la enzima (una glucosiltransferasa) que es la encargada de agregar la glucosa a las glicoproteínas para ‘avisar’ a las células que dichas glicoproteínas tienen problemas en su plegamiento.
-Leer su hoja de ruta profesional es en cierta medida adentrarse en una parte importante de la historia de la ciencia argentina y del Instituto Leloir.
Sí, mi padre, un prestigioso médico e investigador del CONICET despertó mi interés por la ciencia. Cuando me recibí de Licenciado en Química en la década de 1960, mi padre decía que el mejor lugar para hacer una tesis doctoral era la Fundación Campomar (hoy Fundación Instituto Leloir). Había tres vacantes a las que se accedía tras aprobar un exigente curso de un semestre de duración. Di el examen y me fui de vacaciones. Luego supe que fui uno de los tres seleccionados. Los otros dos ya habían elegido a su director de tesis. El único jefe de laboratorio que quedaba libre era el doctor Leloir. Colaboré en sus líneas de investigación y terminé mi tesis de doctorado en 1970, el mismo año en que Leloir ganó el premio Nobel de Química.
-¿Cómo influyó en su carrera trabajar con el doctor Leloir?
Fue una experiencia decisiva. Tuve la suerte de trabajar bajo su dirección durante 7 años, en un momento que abrió todo un campo de la bioquímica que es la síntesis de glicoproteínas, un área de la investigación en la que continué trabajando, no solo yo sino varios grupos de investigación de todo el mundo. Esta línea de investigación es muy importante. Los anticuerpos, muchas hormonas y muchas enzimas son glicoproteínas que cumplen un rol clave en procesos vitales.
-Usted ha dicho más de una vez que el doctor Leloir podría haber ganado otro premio Nobel por sus trabajos sobre la síntesis de glicoproteínas.
Así es. Él obtuvo el máximo galardón de la ciencia por describir los mecanismos de síntesis de compuestos que tienen azúcares, un proceso clave de la vida. Describió cómo se almacenan los azúcares en animales bajo la forma de glucógeno y de almidón en plantas y el modo en que se utilizan como fuente de energía. Estos trabajos permitieron explicar muchas enfermedades hereditarias como la galactosemia. Pero sus trabajos pioneros en la formación de glicoproteínas son de igual relevancia.
-¿Qué otras huellas le dejó Leloir?
De Leloir aprendí modos eficientes de trabajar en equipo, encarar preguntas, diseñar experimentos y analizar los resultados. Estimulaba la autonomía. Ni bien comencé a trabajar con él, fabricábamos algunos de nuestros equipos de laboratorio para realizar experimentos. En 1965 construimos el primer “vortex” utilizado en el instituto. Este aparatito sirve para mezclar y homogeneizar las sustancias contenidas en tubos de ensayo. Lo construimos con el motor de un secador de cabello en desuso de mi hermana y funcionaba muy bien. Por otra parte, al igual que Leloir, siempre me gustó realizar experimentos con mis propias manos, en tareas compartidas con mis becarios.
 Proteína sin azúcar (izq.) y con azúcar (glicoproteínas). Ciertas enfermedades congénitas se producen a causa de mutaciones en diversas glicoproteínas claves para la vida del ser humano. Parodi logró explicar por qué la maquinaria celular no es capaz de llevar a dichas moléculas a adoptar una estructura tridimensional correcta y/o no puede la célula detectar que está mal plegada y así destruirla.
Proteína sin azúcar (izq.) y con azúcar (glicoproteínas). Ciertas enfermedades congénitas se producen a causa de mutaciones en diversas glicoproteínas claves para la vida del ser humano. Parodi logró explicar por qué la maquinaria celular no es capaz de llevar a dichas moléculas a adoptar una estructura tridimensional correcta y/o no puede la célula detectar que está mal plegada y así destruirla.-¿Qué opina sobre la distinción entre ciencia básica y aplicada?
Esta distinción es falaz. Lo que existe es ciencia y aplicación de la ciencia. Prácticamente todos los grandes avances en biotecnología y en tecnología propiamente dicha derivan de estudios básicos seguidos no con un fin práctico determinado sino simplemente con la finalidad de aumentar el conocimiento que posee la humanidad sobre la naturaleza. Este aumento es la estrategia que, a la larga, ha brindado los mayores avances en el diagnóstico y tratamiento de enfermedades humanas. Hay una infinidad de investigaciones brillantes que buscando, no explicar enfermedades, sino el funcionamiento de las células, llevaron inesperadamente al desarrollo de diagnósticos y tratamientos eficaces para muchas patologías. En mi caso personal, el estudio de cómo se forman las glicoproteínas en un microrganismo (Trypanosoma cruzi) llevó a explicar un sinnúmero de patologías humanas. Algo realmente inesperado y que muestra tanto la utilidad como la belleza de la investigación básica.